La configuración electrónica describe cómo se distribuyen los electrones en los distintos niveles de energía y orbitales de un átomo. Su importancia radica en que permite comprender la estructura interna de los elementos y explicar su comportamiento químico.
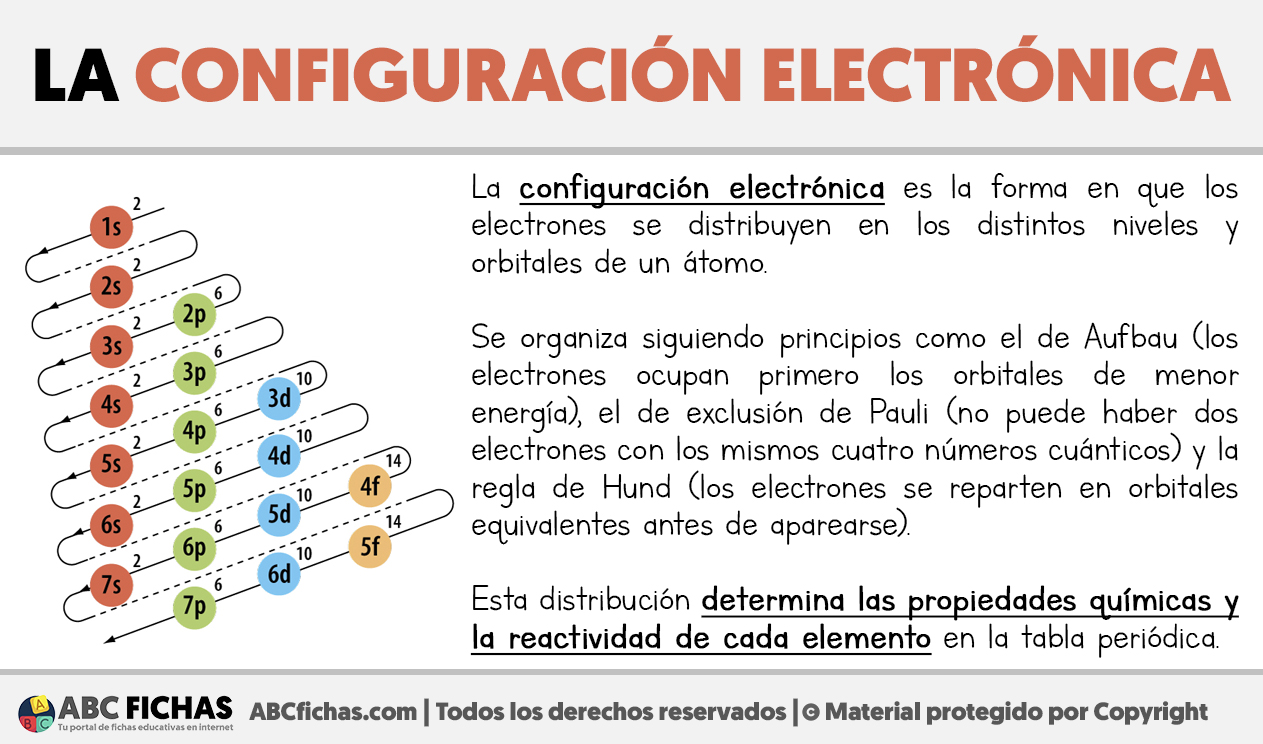
La configuración sigue una serie de principios fundamentales: el principio de Aufbau, que establece que los electrones ocupan primero los orbitales de menor energía; el principio de exclusión de Pauli, que prohíbe que dos electrones tengan los mismos cuatro números cuánticos; y la regla de Hund, que indica que los electrones se ubican en orbitales degenerados (de igual energía) de manera individual antes de aparearse.
La notación se expresa con números y letras, como en el caso del oxígeno: 1s² 2s² 2p⁴. Aquí se indica que en el nivel 1, orbital s, hay 2 electrones; en el nivel 2, orbital s, también 2; y en el orbital p del mismo nivel, 4 electrones.
La configuración electrónica está íntimamente relacionada con la tabla periódica: determina la posición de cada elemento, su número de valencia, y por tanto, sus propiedades químicas. Explica por qué los gases nobles son estables, por qué los metales alcalinos son muy reactivos o por qué los halógenos tienden a ganar electrones.